纳武利尤单抗是一种可与PD-1受体结合的单克隆抗体,可阻断PD-1与PD-L1、PD-L2的相互作用,解除PD-1通路介导的免疫应答抑制,恢复肿瘤特异性T细胞免疫。小编整理了纳武利尤单抗在非小细胞肺癌(Non Small Cell Lung Cancer,NSCLC)和小细胞肺癌(Small Cell Lung Cancer,SCLC)中的系列研究,有助于我们更深入的认识PD-1抗体—纳武利尤单抗。BFR帝国网站管理系统
Checkmate-012是一项Ⅰ期、多队列研究,提示nivolumab单抗作为晚期NSCLC的一线治疗结果令人鼓舞[2]。然而,随后启动的Ⅲ期随机对照临床研究CheckMate-026并没有取得预期的成功。BFR帝国网站管理系统
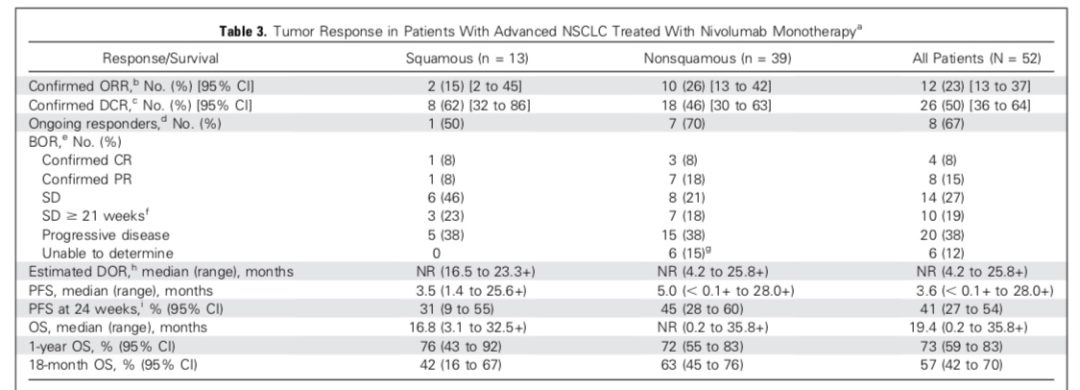
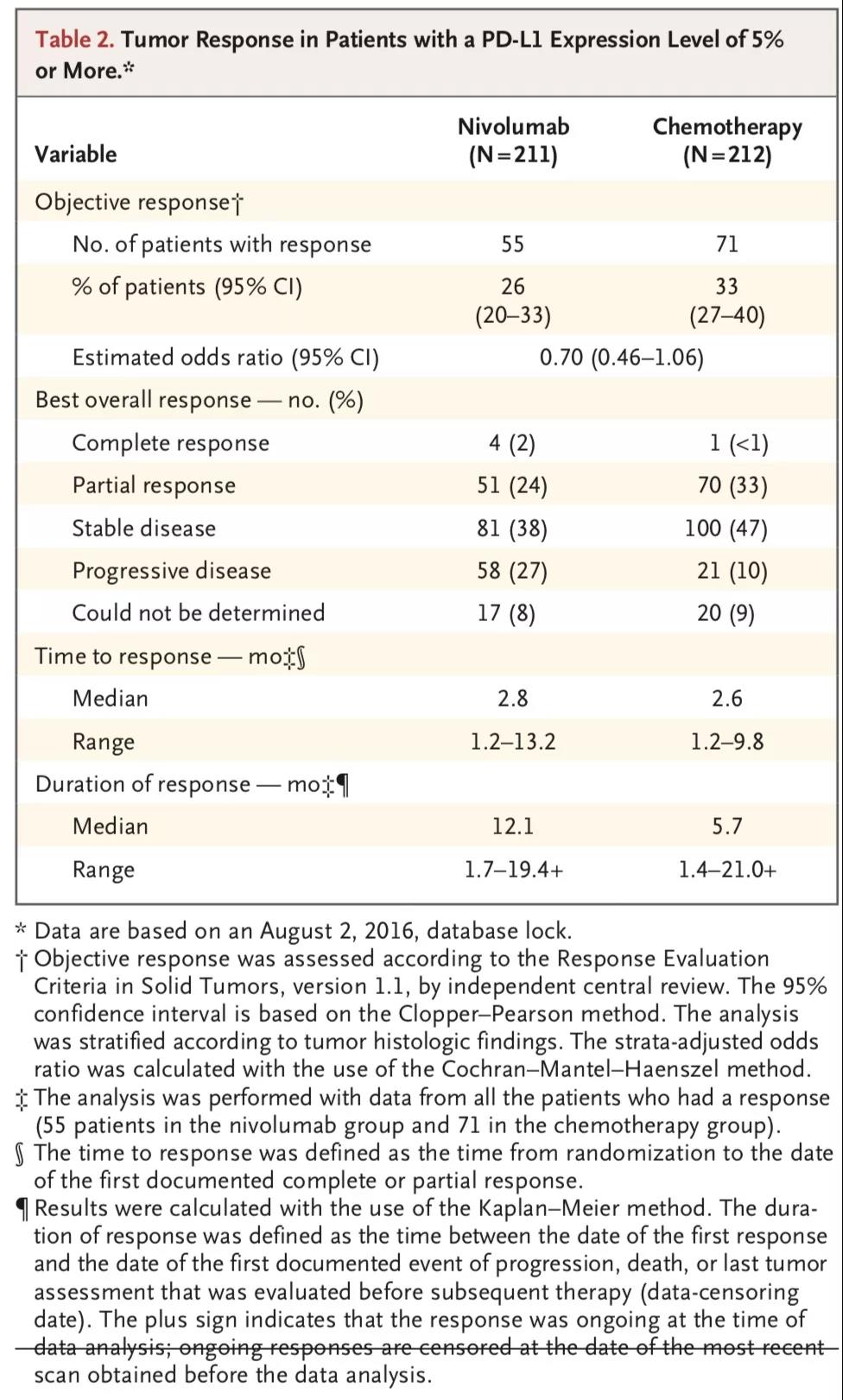
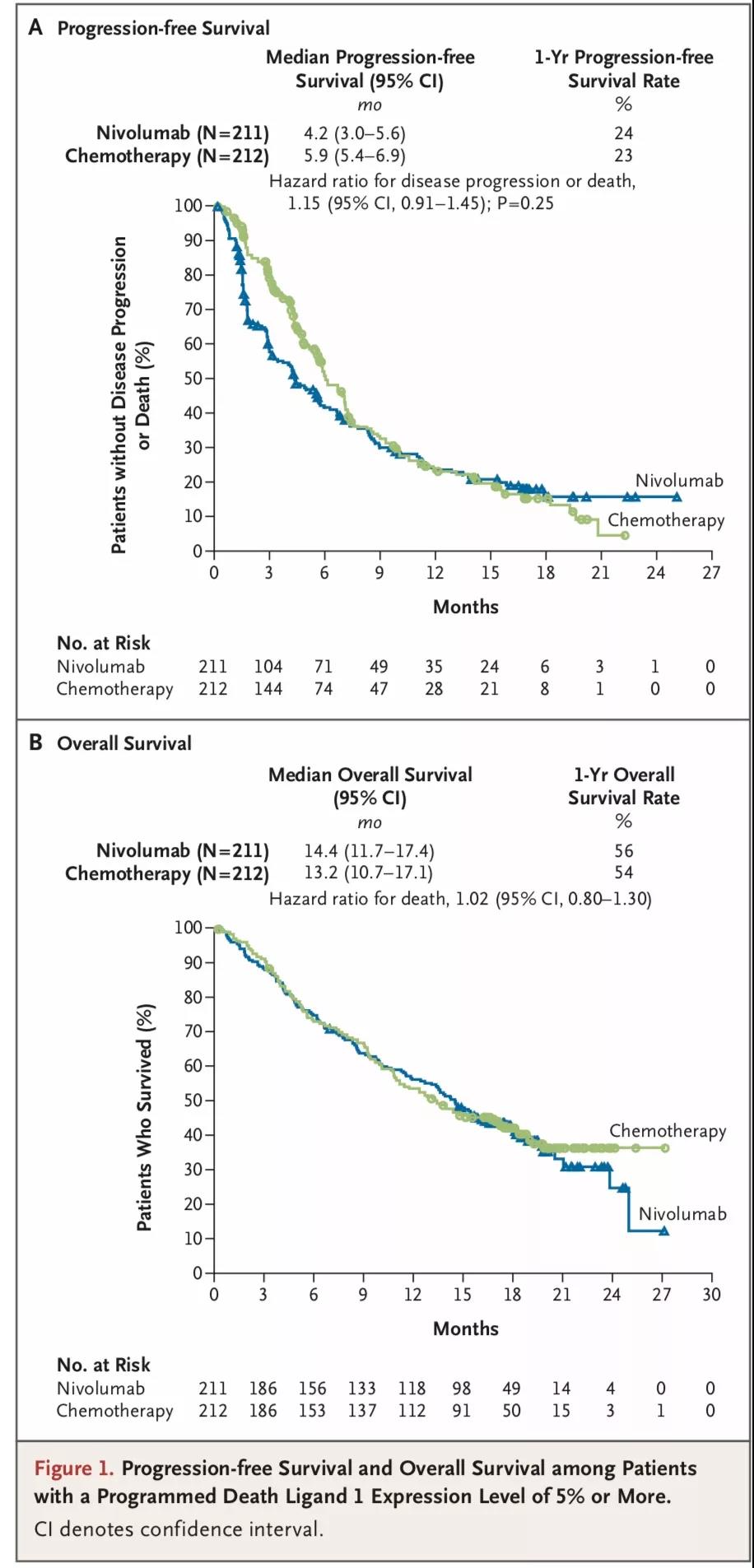
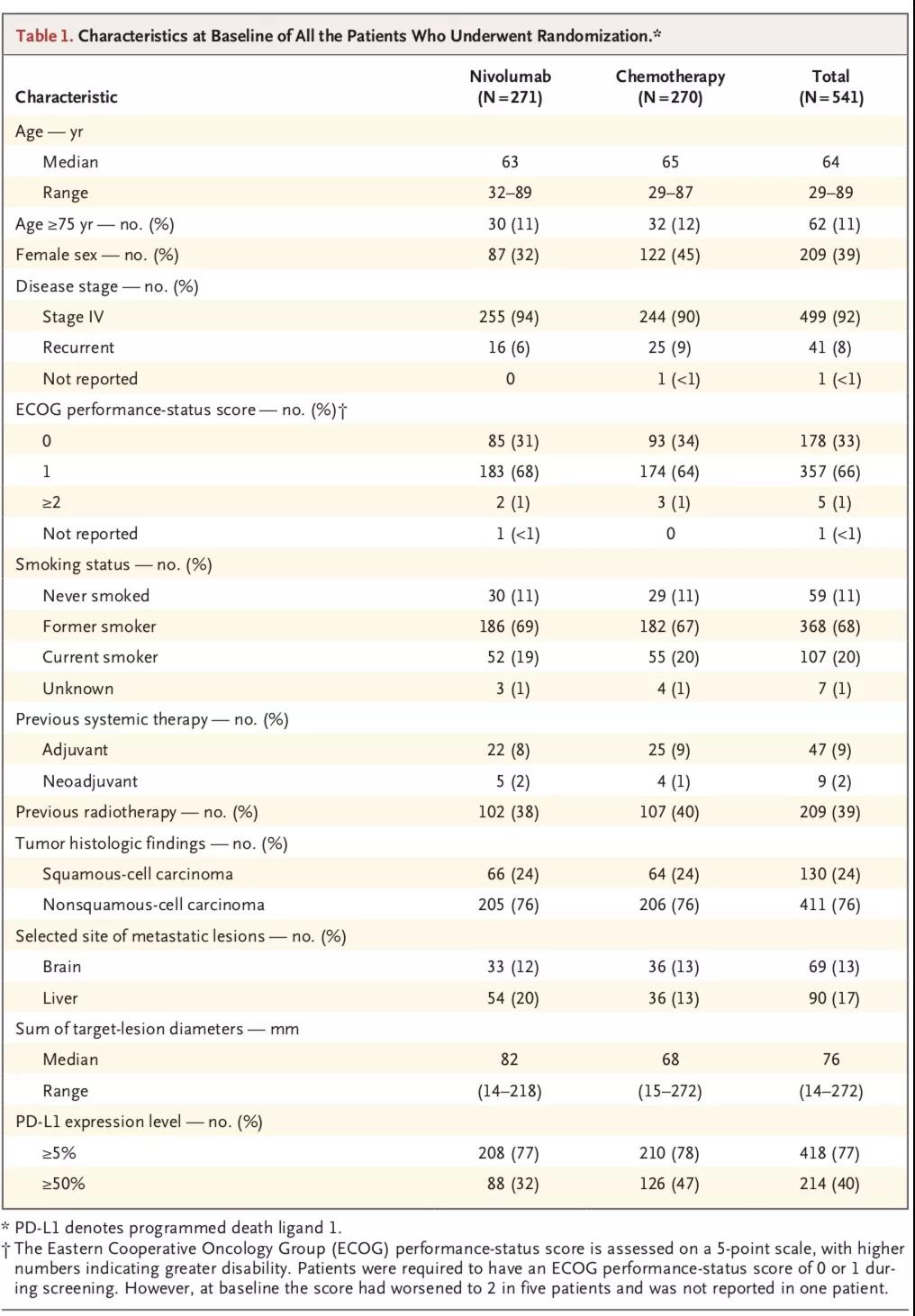
CheckMate-026[3]是一项开放标签、随机分组Ⅲ期研究,主要考察一线使用nivolumab与研究者选择的化疗方案在晚期NSCLC患者中的疗效差异。入组的541例患者之前未接受过全身性治疗,而且经检测为PD-L1表达阳性(PD-L1≥1%)。受试组接受静脉注射Nivolumab 3mg/kg(每2周1次),对照组给予研究者选择的化疗方案,给药一直持续到疾病进展、出现不可接受毒性事件或完成6个给药周期。研究的主要终点是PD-L1表达≥5%的患者的PFS。数据显示,在PD-L1表达≥5的患者中,Nivolumab和含铂标准化疗组合的中位PFS分别为4.2个月vs 5.9个月(HR=1.15,95% CI:0.91~1.45)。奇怪的是,即使PD-L1表达≥50%的患者,Nivolumab治疗组与化疗组PFS仍然没有差别。在PD-L1≥5%的人群中,Nivolumab治疗组与化疗组ORR分别为26%、33.5%,无统计学差异。对于PD-L1表达≥50%的患者,两组的ORR分别为34%、39%,仍然没有统计学差异。OS为14.4个月vs 13.2个月(HR=1.02,95% CI:0.80~1.30)。化疗患者疾病进展后有60%转为交叉使用Nivolumab进行后续治疗。Nivolumab的安全性与既往研究一致。CheckMate-026表明,Nivolumab一线治疗晚期NSCLC对比传统化疗在PFS、OS方面并未取得优势。
在后续探索性标志物分析发现,CheckMate-026研究在肿瘤突变负荷较高的患者中,Nivolumab组和化疗组患者的ORR分别为47%和28%,中位PFS分别为9.7个月和5.8个月(HR=0.62,95%CI:0.38~1.00)。中位OS相似,不受肿瘤突变负荷的影响[7]。从这个回顾性的TMB亚组分析可以看到,对突变负荷高的那部分患者,Nivolumab一线治疗PFS可能优于标准化疗,当然这需要前瞻性的临床研究进一步证实。BFR帝国网站管理系统
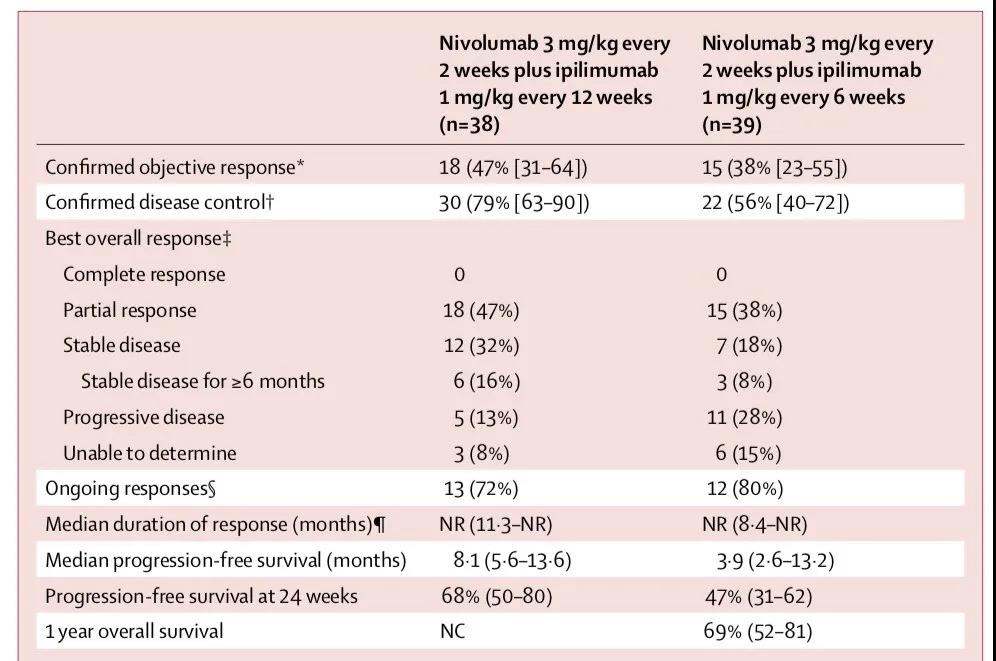
CheckMate012[4]这项Ⅰ期多队列研究旨在评估nivolumab联合Ipilimumab一线治疗晚期NSCLC的疗效和安全性。研究结果显示,nivolumab联合Ipilimumab一线治疗晚期NSCLC具有良好的临床获益,包括PD-L1+肿瘤患者的高反应率以及深度和持续反应的可能性,且安全性较好、耐受性佳。CheckMate012研究是第一个证实免疫治疗组合改善NSCLC一线治疗获益的证据。
 BFR帝国网站管理系统
BFR帝国网站管理系统
之前对未接受过化疗的晚期非小细胞肺癌(NSCLC)患者进行了一项1期试验,试验中纳武利尤单抗联合伊匹单抗一线免疫治疗被证实具有临床疗效和可耐受的毒性(CheckMate 012; Lancet Oncol 2017; 18:31)。此外,在对接受免疫治疗的NSCLC患者进行的一项回顾性研究中,肿瘤突变负荷较高(TMB)与应答改善相关(NEJM JW Oncol Hematol Mar 2018和J Clin Oncol 2018;36:633)。在此基础上进行了CheckMate 227研究。BFR帝国网站管理系统
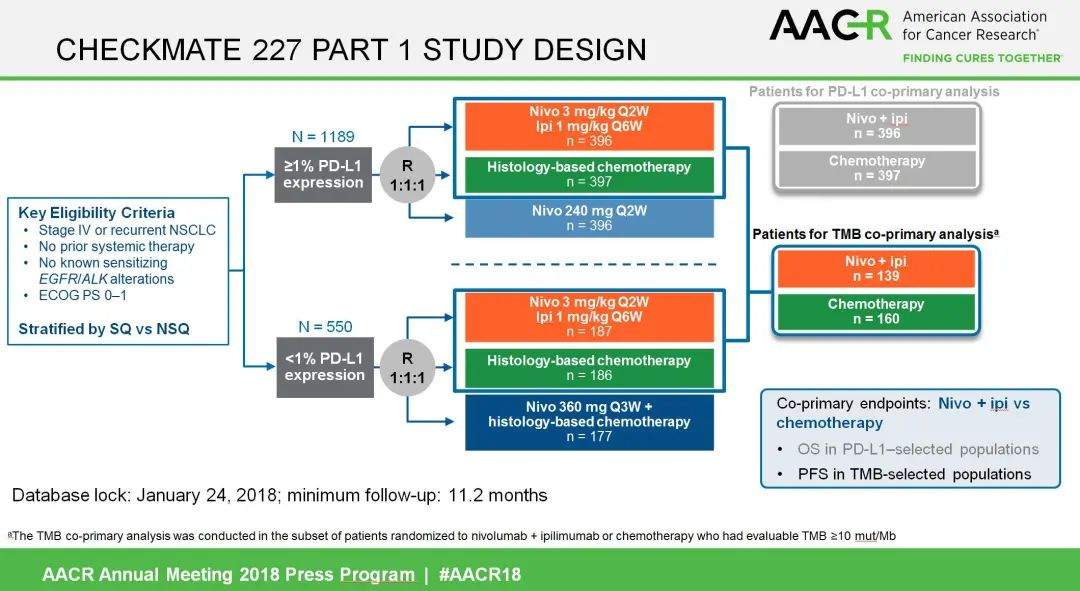
CheckMate-227研究:本研究是针对驱动基因阴性晚期NSCLC(鳞癌、非鳞癌)的开放、随机、Ⅲ期临床试验,旨在探索免疫单药治疗、含铂化疗,以及双免疫联合作为晚期NSCLC一线治疗方案的疗效和安全性,以及生物标志物对疗效的影响。BFR帝国网站管理系统
 BFR帝国网站管理系统
BFR帝国网站管理系统
第1部分:1a部分比较免疫单药、双免联合、含铂化疗(1:1:1的3队列研究)在PD-L1≥1%患者的疗效;1b部分比较双免联合、免疫联合化疗、含铂化疗(1:1:1的3队列研究)在PD-L1<1%患者的疗效;BFR帝国网站管理系统
第2部分:不考虑PD-L1表达状态,比较免疫联合化疗与单纯化疗疗效。BFR帝国网站管理系统
1)PD-L1阳性病人:双免疫治疗对比化疗的总生存(在1a部分评估)。
2)高TMB病人(TMB > 10个突变/Mb,无论PD-L1表达状况如何):双免疫治疗对比化疗的无进展生存(在1a和1b部分评估)。BFR帝国网站管理系统
2019年《NEJM》[5]公布29.3个月的随访结果:BFR帝国网站管理系统
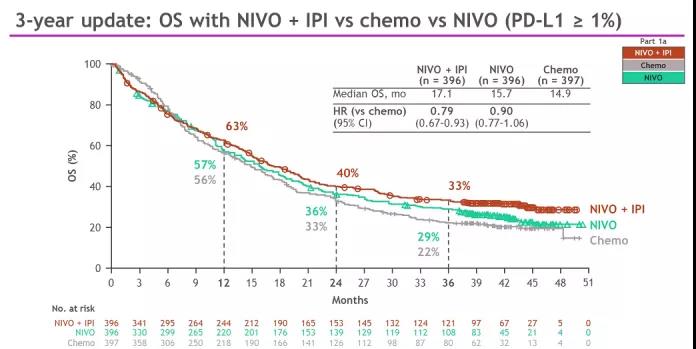
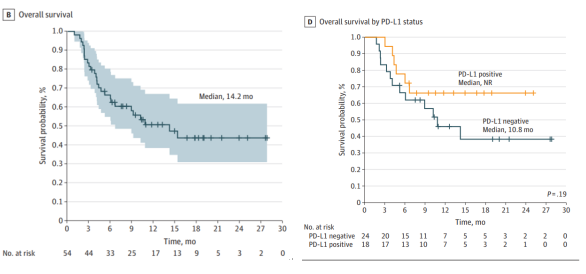
在PD-L1表达水平≥1%的患者中,纳武利尤单抗+伊匹单抗组和化疗组的中位总生存期分别为17.1个月(95% CI,15.0~20.1)和14.9个月(95% CI,12.7~16.7)(P=0.007),2年总生存率分别为40.0%和32.8%。纳武利尤单抗+伊匹单抗组和化疗组的中位缓解持续时间分别为23.2个月和6.2个月。BFR帝国网站管理系统
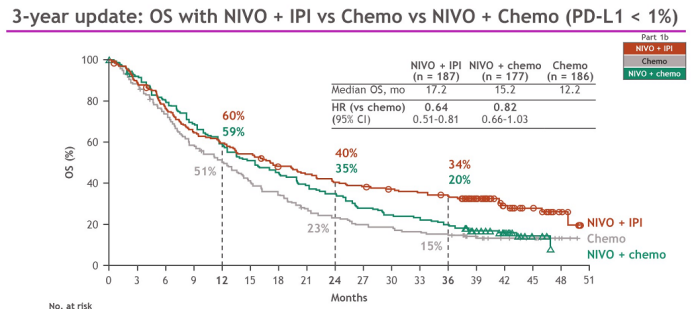
在PD-L1表达水平<1%的患者中,也观察到了总生存期获益[PD-1抑制剂和CTLA-4抑制剂联合治疗对PD-L1表达水平的依赖性降低,但其精确机制尚未明确],纳武利尤单抗+伊匹单抗组和化疗组的中位总生存期分别为17.2个月(95% CI,12.8~22.0)和12.2个月(95% CI,9.2~14.3)。BFR帝国网站管理系统
在本试验的全部患者中,纳武利尤单抗+伊匹单抗组和化疗组的中位总生存期分别为17.1个月(95% CI,15.2~19.9)和13.9个月(95% CI,12.2~15.1)。在总体人群中,纳武利尤单抗+伊匹单抗组和化疗组中发生3级或4级治疗相关性不良事件的患者百分比分别为32.8%和36.0%。
2020ASCO年会公布了43.1个月的随访结果BFR帝国网站管理系统
1)对于PD-L1≥1%,O+Y双免对比标准化疗,OS 为17.1月:14.9月,(HR:0.79;95%CI,0.67-0.93),降低了21%的死亡风险。PFS为5.1:5.6月,(HR:0.81;95%CI,0.69-0.96),ORR为36.4%:30.2%。BFR帝国网站管理系统
BFR帝国网站管理系统
2)对于PD-L1<1%,O+Y双免对比标准化疗,OS 为17.2月:12.2月,(HR:0.64;95%CI,0.51-0.81),降低了36%的死亡风险。PFS为5.1:4.7月,(HR:0.75;95%CI,0.59-0.95),ORR为27.3%:23.1%。BFR帝国网站管理系统
安全性上,无论整体AE发生率(77%:82%),还是3-4级AE发生率(33%:36%),都与化疗相近。BFR帝国网站管理系统
BFR帝国网站管理系统
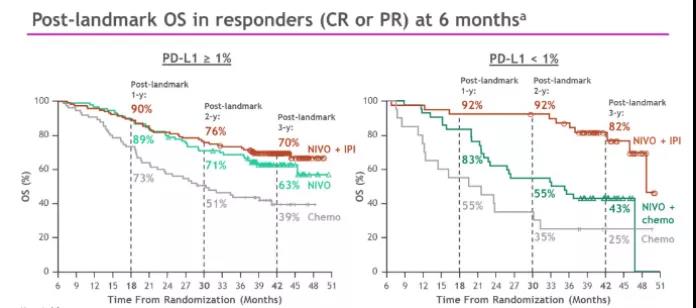
值得注意的是,在PD-L1>1%的患者中,双免疫联合组在6个月时疾病获得缓解(CR/PR)的患者,其1年、2年和3年的OS率都要优于化疗组,其中3年的OS率获益更加明显(高达70%)。提示随着时间的延长,双免疫联合治疗与化疗相比带来的生存获益更加明显。
基于CheckMate-227 研究的Ia部分数据,5月15号,美国FDA正式批准了纳武利尤单抗联合伊匹木单抗的双免疫组合治疗驱动基因阴性的PD-L1>1%的晚期非小细胞肺癌,这是FDA目前批准的首个且唯一一个双免疫治疗NSCLC药物组合。
2019ESMO IMMUNO-ONCOLOGY年会公布了Part2结果:BFR帝国网站管理系统
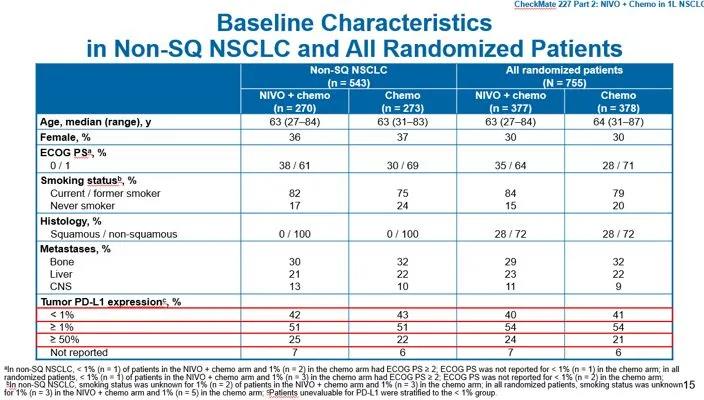
主要终点:一线纳武利尤单抗+化疗相较于单独化疗在非鳞癌患者中OS无统计学差异(中位OS:18.83个月 vs 15.57个月,HR=0.86[95%CI:0.69~1.08])。BFR帝国网站管理系统
在鳞癌人群描述性分析显示有明显延长,并在数值上优于目前一线免疫治疗方案,鳞癌分层有更好的生存趋势(中位OS:18.3个月 vs 11.9个月,HR=0.69[95%CI:0.50~0.97];KEYNOTE-407研究中位OS:15.9个月 vs 11.3个月,HR=0.64[95%CI:0.49~0.85])。BFR帝国网站管理系统
BFR帝国网站管理系统
2020ESMO大会上, CheckMate 227研究公布亚洲亚组研究数据。BFR帝国网站管理系统
研究结果:分别有121例、124例亚洲患者被随机至双免疫联合治疗组和化疗组。数据截止2019年7月2日,OS的最小随访时间为29.7个月。在PD-L1≥1%的人群中(两组均为81例患者),双免联合方案降低了24%的疾病死亡风险,两组的中位OS分别为未达到和24.8个月(HR=0.76)。两组中位PFS分别为11.0和6.7个月(HR=0.64);ORR分别为54%和37%;中位DOR分别为26.1和6.9个月。在所有随机患者中(PD-L1≥1%和<1%),同样观察到双免联合治疗组在疗效上的改善:中位OS分别为未达到和22.9个月(HR=0.68);中位PFS分别为8.5和5.6个月(HR=0.66);ORR分别为57%和41%;中位DOR分别为24.5和5.6个月。BFR帝国网站管理系统
BFR帝国网站管理系统
安全性:双免疫联合治疗和化疗组分别观察到40%和36%的患者发生3-4级治疗相关不良事件,两组中任何等级治疗相关不良事件(TRAE)导致停药率分别22%和13%。与全球数据一致,纳武利尤单抗联合伊匹木单抗相比化疗能够改善亚洲患者的疗效,同时在安全性也相似。
CheckMate-9LA研究[6]:是一项国际、多中心、随机III期临床研究,为了弥补免疫起效慢、假性进展等不足,探讨双免疫联合疗法加上有限周期的化疗能否为患者带来快速的疾病控制[CheckMate-227研究治疗初期,无论是双免治疗组还是化疗组,均观察到生存曲线出现交叉的情况,意味着有部分患者无法获益]。研究纳入组织病理学确认的IV期非小细胞肺癌患者,PS评分为0~1分,无症状中枢神经系统转移或症状稳定的脑患者允许入组,患者不携带驱动基因突变。符合入组标准的患者,按照1:1的比例随机分为纳武利尤单抗联合Ipilimumab并进一步联合两周期化疗(联合治疗组)或单独化疗(单纯化疗组)。研究基于组织病理类型、性别、PD-L1表达水平(以1%作为截断值)进行分层。符合入组标准的患者接受纳武利尤单抗 (360 mg,每三周一次)联合Ipilimumab (1mg/kg,每6周一次)联合两周期化疗或单纯化疗。化疗方案为卡铂(AUC=6)或顺铂(75 mg/mg2)、培美曲赛(腺癌,500 mg/mg2)或紫杉醇(鳞癌:200 mg/mg2),接受培美曲塞治疗的患者,允许进行培美曲塞维持治疗。本研究不允许交叉。前12个月每6周进行一次疗效评估,随后每12周进行一次疗效评估。治疗应当持续进行,直至疾病进展、出现不可耐受毒性反应或患者撤销知情同意。BFR帝国网站管理系统
本研究的主要终点为OS,续贯次要终点为PFS、ORR,其他次要终点包括基于TMB分析的疗效参数。BFR帝国网站管理系统
从2017年8月至2019年1月,共计1150例患者接受筛选,最终719例患者接受随机化。联合免疫治疗组及单纯化疗组分别入组361例和358例患者,两组分别有99%和97%的患者接受随机化后接受了至少一次治疗。
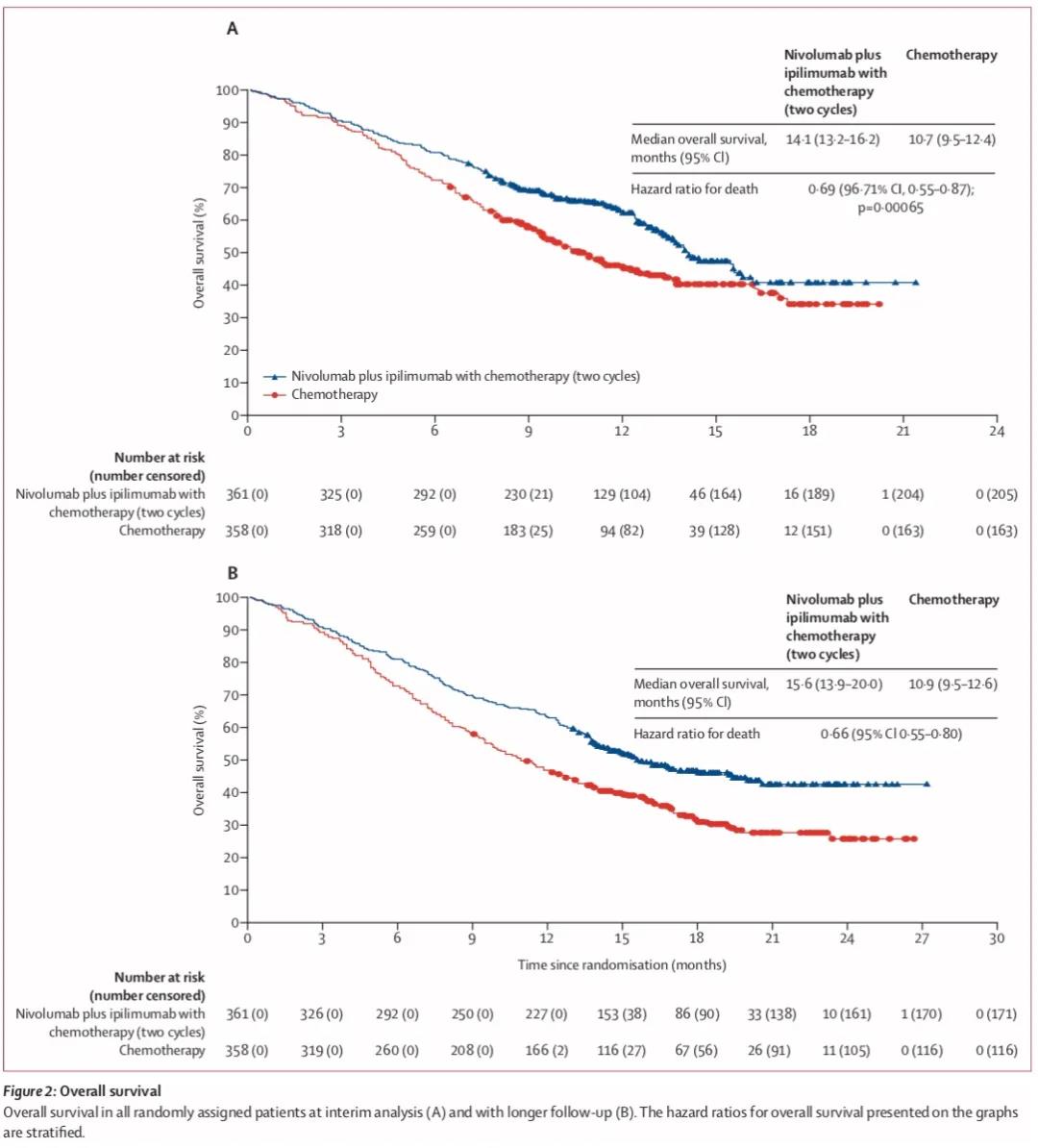
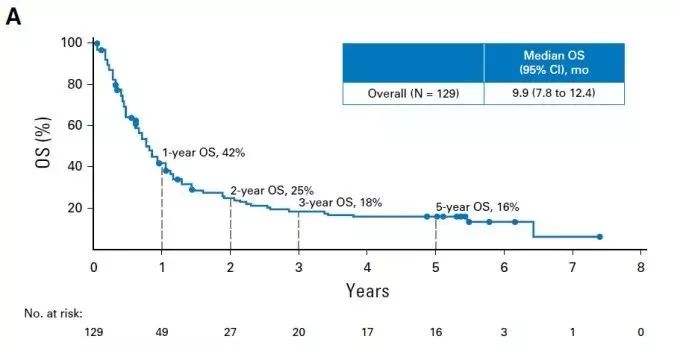
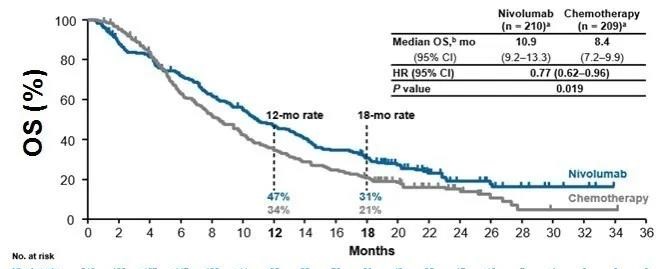
研究结果:1)OS:首次数据分析时,两组分别有43%和54%的患者出现死亡事件。中位OS分别为14.1个月和10.7个月,HR=0.69。经过额外4.6个月,即全组中位13.2个月的随访后,数据于2020年3月锁库,此时,联合免疫治疗组和单纯化疗组分别有53%和68%的患者出现死亡事件。更新后,两组的中位OS分别为15.6个月和10.9个月,HR=0.66,12个月OS率分别为63%和47%。
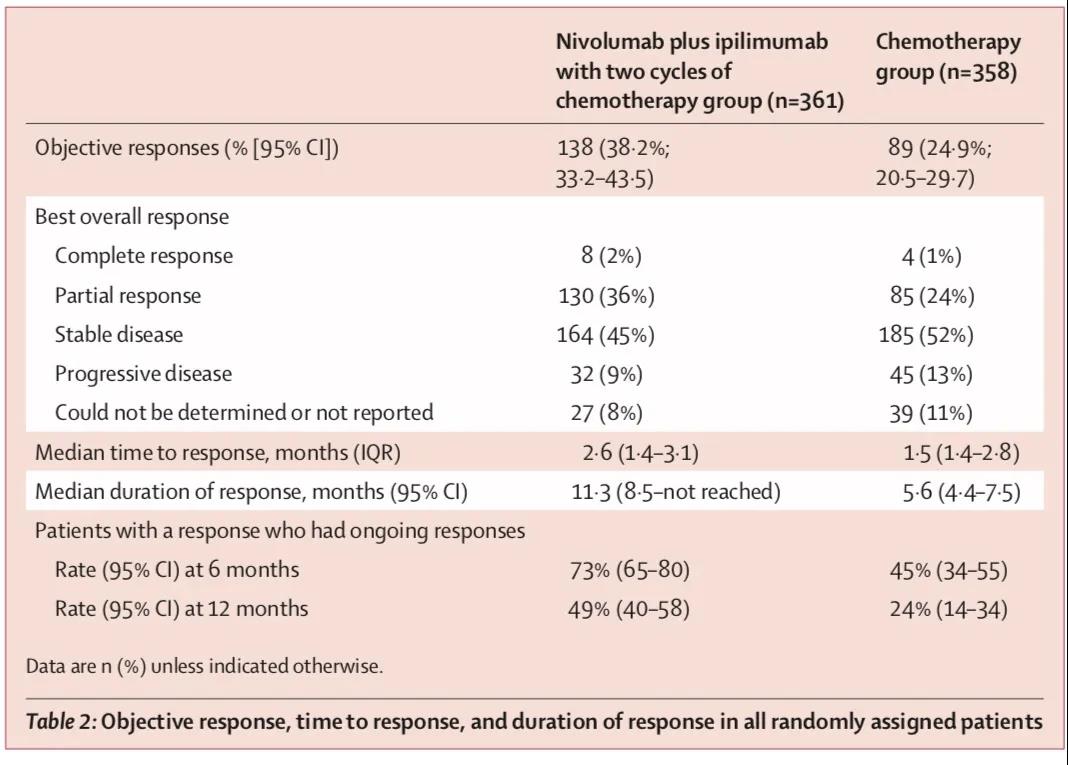
2)PFS及ORR:首次分析时,两组分别有64%和70%的患者出现PFS事件,中位PFS分别为6.8个月和5.0个月,HR=0.70。两组ORR分别为37.7%和25.1%。更新后的数据,两组分别有69%和74%的患者出现PFS事件,中位PFS分别为6.7个月和5.0个月,HR=0.68,ORR与之前报道的数据相似,独立评审委员会评估的数据和研究者评估的数据相似。
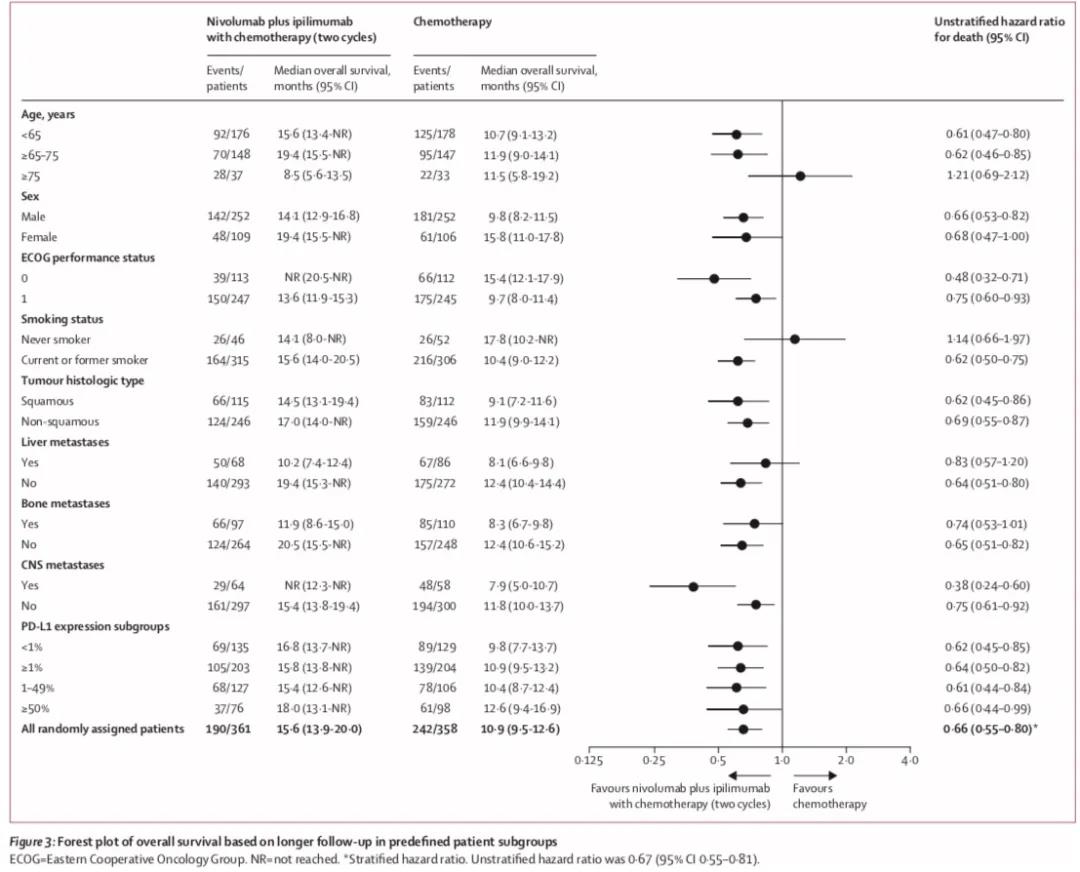
3)在多数预设的亚组中均观察到联合免疫治疗组的获益,且这一获益与PD-L1表达水平及组织病理类型无关(左图)。PD-L1<1%的患者,两组中位OS分别为16.8个月和9.8个月,HR=0.62,;PD-L1≥1%的患者,两组的中位OS分别为15.8个月和10.9个月,HR=0.64,;非鳞癌患者,两组中位OS分别为17.0个月和11.9个月,HR=0.69;鳞癌患者两组中位OS分别为14.5个月和9.1个月,HR=0.62(右图)。
不同PD-L1表达水平及组织病理亚型OSBFR帝国网站管理系统
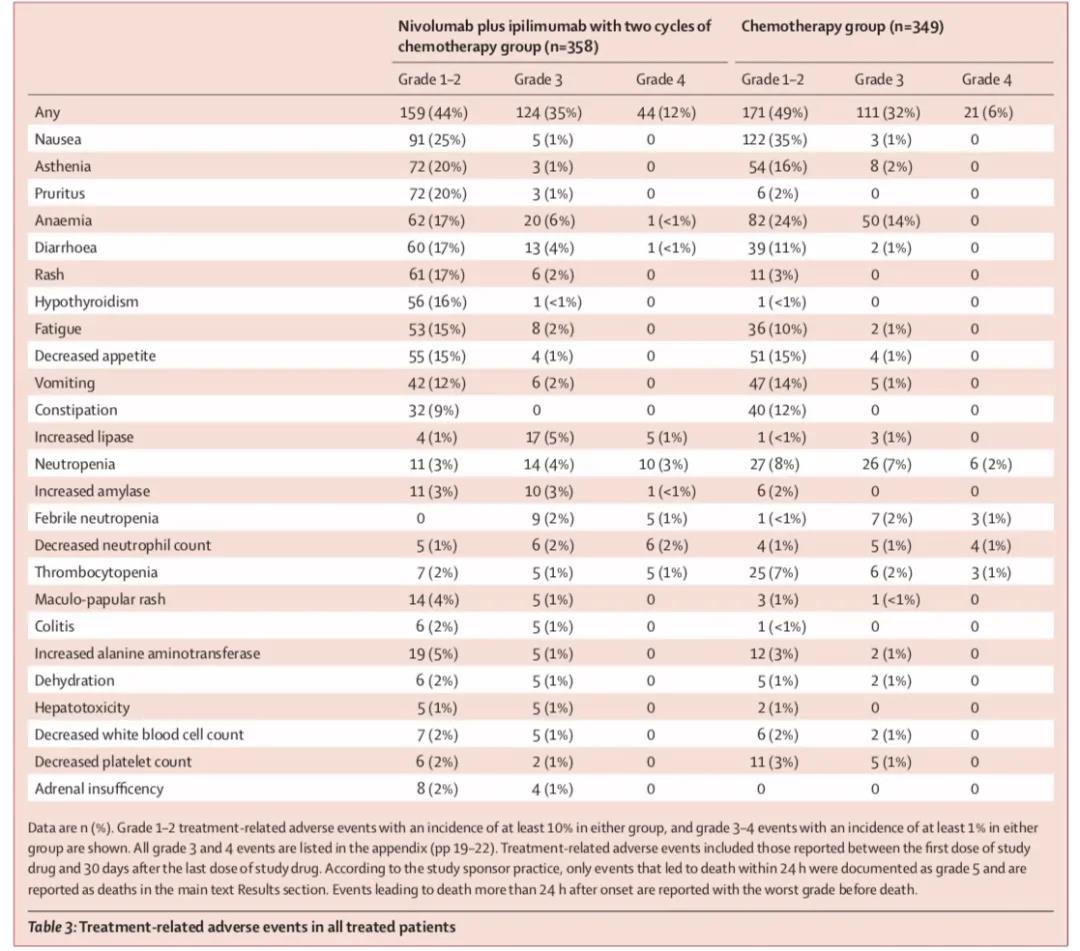
安全性:两组3-4度治疗相关不良反应发生率分别为47%和38%。最常见的分别为中性粒细胞下降(7% vs. 9%),贫血(6% vs. 14%),腹泻(4% vs. 1%),脂肪酶升高(6% vs. 1%),乏力(1% vs. 2%)。治疗相关的严重不良反应发生率分别为30%和18%,并导致了19%和7%的患者治疗终止,两组均有2%的患者因治疗相关的不良反应导致死亡事件出现。
 BFR帝国网站管理系统
BFR帝国网站管理系统